Данная работа посвящена изучению вклада бесклеточного слоя вблизи стенки сосуда в гемодинамику в крупной коронарной артерии со стенозом с целью оценки актуальности моделирования бесклеточного слоя для нужд интервенционной кардиологии. В рамках работы рассмотрена двухкомпонентная модель описания кровотока в прямом сосуде со стенозом и проведено сравнение с широко используемой однокомпонентной реологической моделью.
Постановка задачи
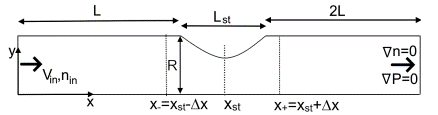
В работе модель Эйлера-Эйлера, рассматривающая кровь как двухкомпонентную жидкость с дискретной фазой эритроцитов и жидкой фазой плазмы, была применена к простому сосуду со стенозом. Расчетная область, представляющая собой 2D сосуд со степенью стеноза 65%, показана на рис. 1. На входной границе задавались скорость и концентрация эритроцитов, на выходе – нулевой градиент для статического давления и концентрации эритроцитов.
Рис. 1. 2D сосуд со стенозом
В рамках исследования компьютерное моделирование проводилось для условий, типичных для коронарных сосудов человека, что позволило сравнить как макроскопическую гемодинамическую ситуацию (профили скорости и образование вихрей), так и микроскопические характеристики (локальный гематокрит, вязкость и напряжения сдвига стенки).
Результаты исследования
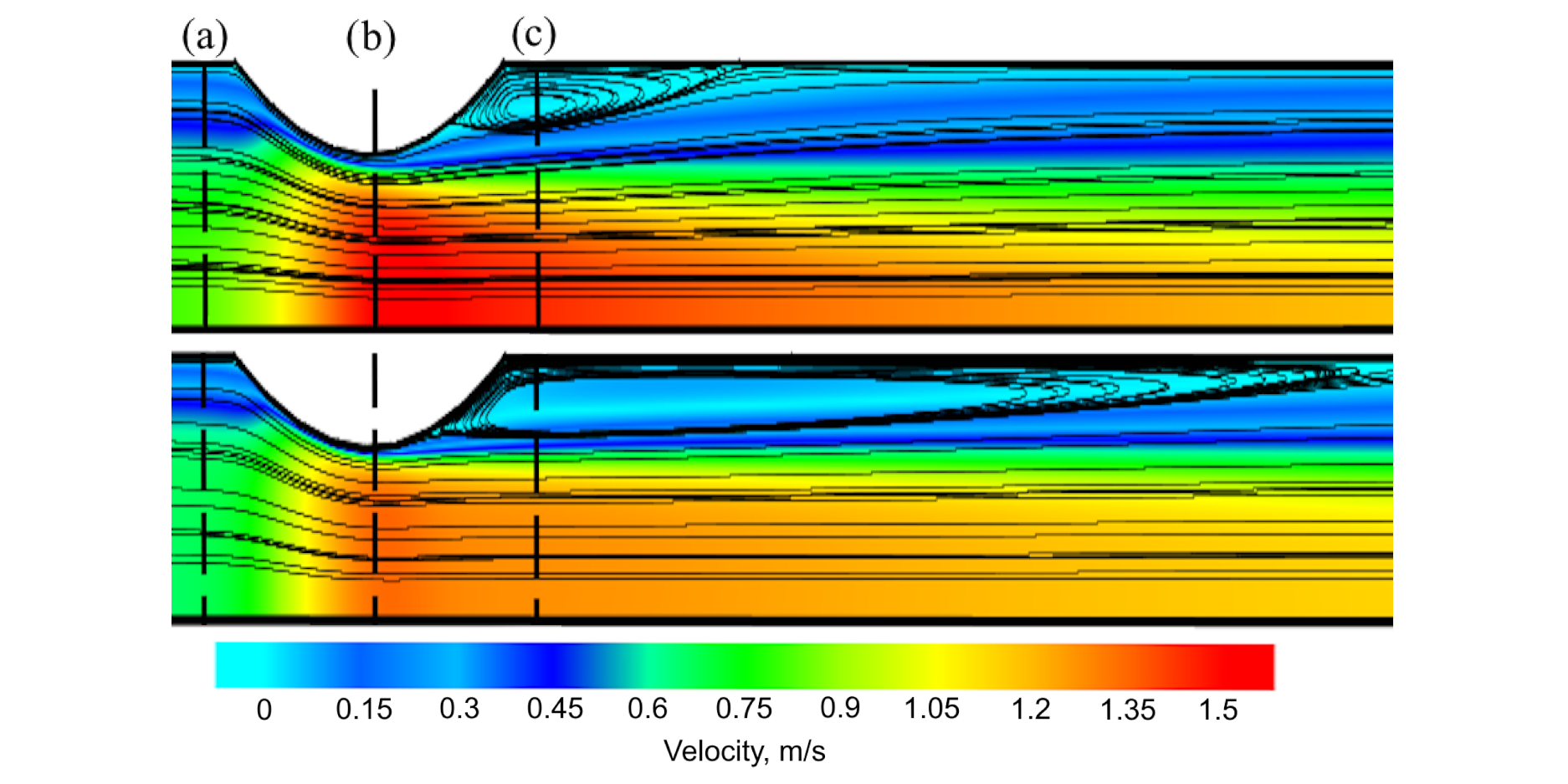
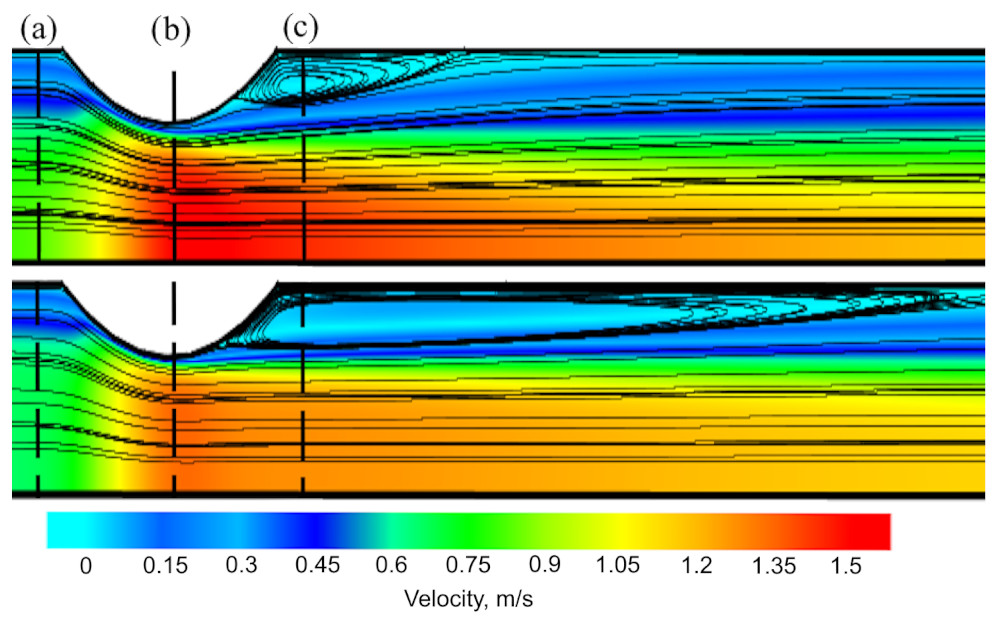
Сравнение результатов, полученных с помощью двухкомпонентной модели, и моделирования, проведенного с использованием однокомпонентной модели, показало значительную количественную и качественную разницу, основной причиной которой является бесклеточный слой. Этот пристеночный слой низкой вязкости действует как смазка для основного потока, что принципиально меняет гемодинамику. На рис. 2 показаны размер и форма вихря в случае однокомпонентной и двухкомпонентной модели. Появление бесклеточного слоя во втором случае растянуло вихревую зону в несколько раз.
Рис.2. Области рециркуляции после стеноза. Верхняя панель: однокомпонентная модель Карро; нижняя панель: двухкомпонентная модель.
Простые однокомпонентные модели не учитывают локальный гематокрит и, следовательно, не могут воспроизвести бесклеточный слой и завышают вязкость вблизи стенки, что может быть оправдано только для сильно искривленных участков сосудов или закрученных потоков, где концентрации эритроцитов практически однородны.
Кроме того, показано, что процесс формирования бесклеточного слоя неоднороден по длине сосуда и нестационарен во времени. Это явление объясняется тем, что на толщину бесклеточного слоя влияет совокупность переменных сил и эффектов, таких как гидродинамическая сила взаимодействия эритроцитов и плазмы; силы отталкивания от стенки, в том числе эффекты деформации клеток и их упругого взаимодействия друг с другом.
Таким образом, для реальных трехмерных сосудов с нестационарной пульсацией крови предложенная модель, явно учитывающая локальный гематокрит, существенно превосходит предложенные ранее двух- и многослойные стационарные реологические модели, в которых толщина бесклеточного слоя предполагается однородной вдоль сосуда.
Читать полностью (на английском языке) PDF 1310KB
Ilya Starodumov (1,2), Ksenia Makhaeva (1,3), Andrey Zubarev (1), Ivan Bessonov (4), Sergey Sokolov (1,2), Pavel Mikushin (1,5), Dmitri Alexandrov (3), Vasiliy Chestukhin (6), Felix Blyakhman (1,2) Modeling of Local Hematocrit for Blood Flow in Stenotic Coronary Vessels // Fluids 2023, 8(8), 230
(1) Laboratory of Multiphase Physical and Biological Media Modelling, Department of Theoretical and Mathematical Physics, Ural Federal University, Ekaterinburg 620000, Russia
(3) Laboratory of Multi-Scale Mathematical Modeling, Department of Theoretical and Mathematical Physics, Ural Federal University, Ekaterinburg 620000, Russia
(4) Tyumen Cardiology Research Center, Tomsk National Research Medical Center, Russian Academy of Sciences, Tomsk 625026, Russia
(5) Moscow Institute of Physics and Technology, Moscow 141701, Russia
(6) Sklifosovsky Research Institute of Emergency Care, Moscow 129090, Russia
This mainly theoretical work is devoted to the study of the contribution of the cell-free layer (CFL) near the vessel wall to hemodynamics in a large coronary artery with stenosis to assess the relevance of CFL modeling to the needs of interventional cardiology. An Euler–Euler model considering blood as a two-component fluid with a discrete phase of erythrocytes and a liquid plasma phase was applied to a simple 2d vessel with 65% stenosis. It was found that both the CFL thickness and the local contribution of the CFL thickness to hemodynamics are inhomogeneous along the vessel. The effects of CFL on the velocity profiles, vortex formation, hematocrit, viscosity, and wall shear stresses in the area of stenosis were determined. To demonstrate the significance of CFL modeling for prognostic purposes, the same hemodynamic conditions, analyzed using a one-component model, were also considered. A comparison analysis showed that the existence of CFL resulted in a significant overestimation (up to over 100%) of the main hemodynamic characteristics of the flow obtained using the model based on the Carreau equation.